«Parmi toutes les crises d'origine sociale ou naturelle auxquelles les humains sont confrontés, [celle] de l'eau est au cœur de notre survie et de la survie de notre planète Terre.» Koïchiro Matsura, directeur général de l'Unesco.
Alors que l’eau est la raison d’être d’une piscine, sa raréfaction est annoncée à l’échelle de la planète. Sa gestion dans une piscine est déjà un enjeu technique et financier et ses couts de productions et d’assainissements devraient croitre régulièrement, pour devenir une véritable enjeu de développement durable. La maitrise de l’eau sera donc au cœur des problématiques du fonctionnement des piscines et centre aquatiques dans les prochaines décennies. Les gestionnaires de ces établissements devront avoir assimilé les éléments réglementaires mais aussi techniques afin de pouvoir piloter les installations et maitriser le fonctionnement de leur établissement dans le respect des normes tout en proposant un plus grand confort de baignade aux usagers, aux clients. Ce chapitre s’adresse donc aux gestionnaires ou à toutes personnes intéressées au fonctionnement des piscines souhaitant posséder un niveau de compétence généraliste. L’objectif est de proposer les connaissances suffisantes qui permettent d’identifier les principaux enjeux : réglementaires - gestionnaires – économiques –environnementaux pour un pilotage efficient de l’équipement. Nous nous proposons également de permettre au gestionnaire de partager avec les techniciens et ingénieurs, les éléments théoriques et le vocabulaire nécessaires à la compréhension des processus inhérents à la gestion de l’eau dans l’équipement. Cette compréhension mutuelle et ces échanges seront d’autant plus nécessaires que le confort des usagers des personnels…et des contribuables dépendent de la qualité des installations mais aussi du niveau d’implication de chacun des acteurs. Pour approfondir le sujet il sera nécessaire de poursuivre la démarche notamment par les lectures complémentaires des documents que nous proposons dans la bibliographie.
LES PARAMÈTRES DE L’ÉQUILIBRE DE L’EAU
L’eau d’une piscine doit être belle, saine et agréable. Pour cela, des traitements doivent être effectué. L’eau d’une piscine est caractérisée par trois paramètres clé : le pH, le Tac et le TH.
Le pH
Le pH (potentiel d’Hydrogène) est la clé de la réussite du traitement de l’eau. Il exprime le pH exprime le caractère acide ou basique sur une échelle graduée de pH 0 à pH 14 : Les valeurs de 0 à 6.9, représentent la partie acide. À 7.0 le pH est neutre. Les valeurs de 7.1 à 14, représentent la partie basique. L’eau d’une piscine est caractérisée par un pH généralement compris entre pH 7 et pH 8. Il doit être idéalement compris entre 7.2 et 7.4, ce qui correspond au pH du liquide lacrymal. A cette valeur, l’eau n’irritera ni les yeux, ni la peau. L’eau est naturellement chargée en éléments dissous, sels de calcium et de magnésium, qui influent à la fois sur l’équilibre et la stabilité de son pH. Au cours du fonctionnement de la piscine différents éléments peuvent modifier le pH : Dégazage du gaz carbonique par agitation (jeux aquatiques), ceci va entrainer une augmentation du pH. Influence des réactifs (désinfectants). Évaporation, ceci va augmenter la concentration en minéraux et conduire à une augmentation du pH. Les corrections pH font intervenir des produits acides ou basiques, conditionnés en poudre ou en liquide. Le tableau ci dessous récapitule ces traitements, ainsi que leur utilisation.
Si pH inférieur à 7,2
Si pH supérieur à 7,2
Produit solide
Traitement
pH plus poudre: carbonate de sodium (soude)
pH minus poudre: bisulfate (ou hydrogénosulfate) de sodium
Utilisation
150 g pour 10 m3 d'eau fait varier le pH de 0,2 unité
Produit liquide
Traitement
pH plus liquide: hydroxyde de sodium 30%
pH minus liquide: acide sulfurique 50%
Utilisation
0,1 L pour 10 m3 d'eau fait varier le pH de 0,2 unité
Ces produits de correction du pH se trouvent sous deux formes:
- En poudre: les correcteurs pH minus et pH plus sont recommandés pour leur utilisation de moindre risque (utilisés principalement dans les piscines privées).
- En liquide: ces correcteurs, conçus pour des doseurs automatiques, sont beaucoup plus puissant (utilisés pour un usage professionnel et par pompe doseuse).
L’alcalinité de l’eau: Titre Alcalimétrique Complet (TAC)
L’alcalinité de l’eau, ou son TAC (Titre Alcalimétrique Complet), caractérise le pouvoir tampon de l’eau, c'est-à-dire la capacité d’influence d’un produit acide ou basique sur le pH de l’eau. Plus le TAC sera faible, moins le pH sera stable. Les valeurs du pH seront grandement modifiées par les apports de correctifs. Elles auront ainsi tendance à faire le « yoyo ». Plus le TAC est élevé, plus le pH sera stable. Une grande quantité de correctifs pH sera nécessaire afin de le faire varier. Le pH sera dit tamponné. D’une manière générale, le TAC doit se situer entre 10°f et 25°f (1°f = 10 mg/L de CaCO3). Pour modifier sa valeur, plusieurs produits peuvent être utilisés:
- Pour le diminuer, il faut détruire le bicarbonate par l’ajout de produit acide (pH minus liquide, par exemple), qu’il faudra limiter à cause de la baisse concomitante du pH.
- Pour l’augmenter, il faut ajouter du bicarbonate de soude (20 g/m3/°f) ou du carbonate de soude si le pH de l’eau est trop bas.
Le Titre Hydrotimétrique de l’eau (TH)
Le Titre Hydrotimétrique de l’eau ou TH est déterminé par la concentration en calcium (Ca++) et en magnésium (Mg++). Une eau est dite douce, si son TH est inférieur à 10°f (1°f = 10 mg/L de CaCO3). Elle est dite dure, si celui-ci est supérieur à 30°f (1°f = 10 mg/L de CaCO3). Il est important de conserver le TH à une valeur proche de 20°f. Pour modifier sa valeur, plusieurs produits peuvent être utilisés : Si le TH est trop haut il faudra utiliser le produit séquestrant calcaire, afin de limiter l’entartrage du filtre, du bassin et des canalisations. S’il est trop faible on peut ajouter du calcium soit par adjonction chlorure de calcium (environ 15 g/m3/°f), soit par passage de l’eau sur un filtre à base de carbonate de calcium.
LES LOIS DE L’ÉQUILIBRE
Le pH, le TAC et le TH sont intimement liés. Ces trois valeurs définissent l’équilibre d’une eau.
Équilibre Calco-carbonique
Les eaux naturelles contiennent divers composés chimiques qui se trouvent sous leur forme dissoute. L’un d’eux est le carbonate de calcium, dont l’équilibre dans l’eau est soumis à des interactions avec le dioxyde de carbone dissous. Cet équilibre chimique, dit équilibre calco-carbonique, est décrit par la réaction (1) : Ca(HCO3)2 << CaCO3 + CO2 + H2O (1) Cette réaction met en évidence le lien entre le bicarbonate de calcium (Ca(HCO3)2), le carbonate de calcium (CaCO3), le dioxyde de carbone dissous (CO2) et l’eau pure (H2O). Cet équilibre chimique relatif au carbonate de calcium peut se déplacer sous l’action du CO2 : c’est ainsi qu’il peut y avoir des réactions de dissolution du carbonate de calcium (l’eau est dite agressive), ou de précipitation du carbonate de calcium (l’eau est dite incrustante).
Relations et diagrammes
Relations simplifiées
Il existe plusieurs relations permettant de définir, pour un pH d’équilibre donné (pHe), les valeurs optimales du TAC et du TH que l’on peut simplifier par les relations suivantes: TH x TAC = 400 à pHe = 7,2 TH x TAC = 300 à pHe = 7,3 avec le TH et le TAC TH x TAC = 200 à pHe = 7,5 exprimés en °f (1°f = 10 mg/L de CaCO3) TH x TAC = 100 à pHe = 7,8
La table de Taylor
La table de Taylor (figure 1) permet de connaître les conditions idéales qu’il faudrait fixer pour avoir une eau équilibrée :
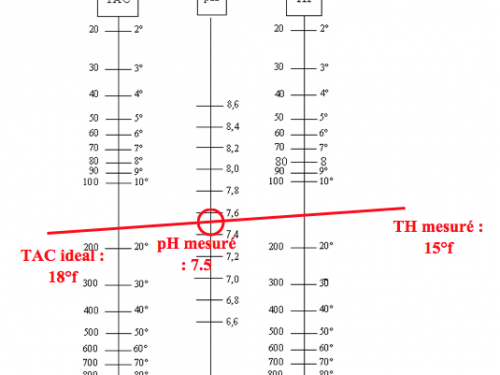
Figure 2: Utilisation de la table de Taylor
Pour un TH et pH mesurés, cette table permet de savoir la valeur du TAC idéal pour obtenir une eau équilibrée. Par exemple, pour un TH de 15°f et un pH de 7.5, le TAC idéal sera de 18°f (1°f = 10 mg/L de CaCO3).
Utilisation de la table de Taylor
L’utilisation de cette table est assez simple. Il suffit de mesurer la valeur du TAC, du pH et du TH et de les reporter sur la table. Si ces 3 points sont alignés, alors l’eau est équilibrée. Sinon, l’eau devra être équilibrée. La démarche à suivre pour équilibrer une eau avec un pH de 7.2 (valeur idéale) est présentée sur la figure (2):
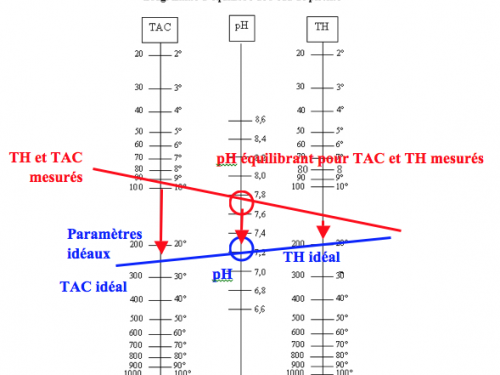
Figure 2: Utilisation de la table de Taylor
Mode opératoire: Vérifier la valeur du TH : Si celui-ci est inférieur à 20°f, augmenter sa valeur jusqu’à 20°f (1°f = 10 mg/L de CaCO3). Sinon, conserver sa valeur (il est difficile de diminuer la valeur du TH). Placer un point sur l’échelle du pH à 7.2 et tracer une droite passant par la valeur du TH et pH = 7,2. Cette droite coupe l’échelle du TAC, donnant ainsi sa valeur idéale pour garantir une eau équilibrée. Faites les ajustements de TAC en fonction de la valeur idéal trouvée (augmenter ou diminuer le TAC pour obtenir cette valeur) Ajuster le pH à 7.2.
Notions d’eau agressive ou entartrante
La table de Taylor permet la vérification rapide de l’état agressif ou entartrant de l’eau. Pour un TH et Tac mesuré, correspond un pH équilibrant (pHe) selon l’équilibre calco-carbonique, présenté sur la figure (3). La comparaison entre le pH équilibrant et le pH mesuré permettra de vérifier l’état agressif ou entartrant de l’eau du bassin:
- Si le pH mesuré est supérieur au pH équilibrant, l’eau sera entartrante (fig.3).
- Si le pH mesuré est inférieur au pH équilibrant, l’eau sera agressive (fig.3).
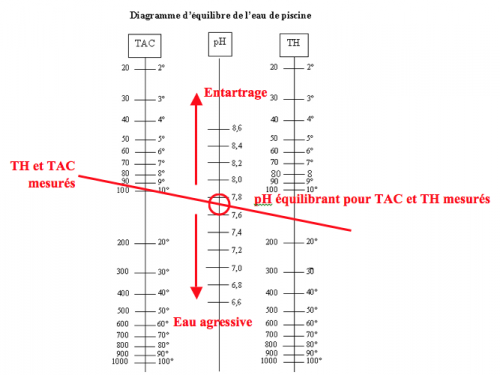
Figure 3: Table de Taylor utilisée pour la détermination d’une eau corrosive ou entartrante
Impact d’une eau entartrante
Lorsque le pH est supérieur au pHe (pH d’équilibre), l’eau devient entartrante. Les phénomènes engendrés seront une augmentation des dépôts de calcaire, une augmentation progressive du pH et un développement bactérien accéléré. En effet, l’eau entartrante précipite le carbonate de calcium et engendre des dépôts de calcaire dans les éléments filtrants, les canalisations et sur le revêtement du bassin. Ces dépôts créeront de nombreuses perturbations: Au niveau du recyclage de l’eau : le débit sera grandement réduit (filtre partiellement obstrué). Il en résultera des zones mortes (absence de brassage) où se développeront des algues. Au niveau du vieillissement des équipements filtrants : comme l’eau se heurte au filtre entartré, la pompe doit fournir plus puissance afin de conserver le débit imposé. Dans le filtre, l’eau doit également se frayer de nouveaux passages, ce qui endommagera celui-ci. Au niveau du bassin : les dépôts calcaires créeront une meilleure accroche pour algues. Celles-ci seront donc plus difficiles à détruire. Au niveau du développement bactérien : comme les bactéries se nourrissent de différents minéraux (dont le calcaire), les dépôts générés seront donc une « réserve de nourriture » et contribueront à leur développement. La température sera un paramètre accélérateur de ce phénomène, car en évaporant de l’eau pure, les minéraux se concentrent et entrainent l’augmentation du pH. Dans le cas présenté sur la figure 3, le pHe est de à 7.7. L’eau va donc précipiter le carbonate de calcium si son pH est supérieur à cette valeur. Dans ces conditions, une eau entartrante créera de nombreux dépôts de calcaire engendrant des départs d’algues dans les zones mortes, qui seront plus difficile à traiter, ainsi qu’un vieillissement accéléré du système de filtration.
Impact d’une eau agressive
Lorsque le pH est inférieur au pHe (pH d’équilibre), l’eau devient agressive. Les phénomènes engendrés seront une augmentation de la corrosion et une agression des revêtements et joints de carrelage. En effet, l’eau agressive dissout les charges minérales contenues dans les revêtements (PVC et joints de carrelage). Ces charges sont de la craie ou carbonate de calcium et leur proportion peut être assez importante, en fonction du type de revêtement. A la place de la craie, il reste des vides qui se remplissent d’eau comme tous les matériaux poreux et mous. La température sera un paramètre accélérateur de ce phénomène, car elle dilate les matériaux et favorise donc l’entrée d’eau dans les pores. Dans le cas présenté sur la figure 3, le pHe est de à 7.7. L’eau va donc dissoudre le carbonate de calcium si son pH est inférieur à cette valeur. Dans ces conditions, une eau agressive créera des pores où pourront se déposer des métaux favorisant l’apparition de traces ou taches. Ainsi, l’étanchéité, la solidité et l’aspect esthétique seront grandement modifiés.
CONCLUSIONS
En qualité d’eau de piscine, le pHe est l’élément le plus important. Même si les eaux de piscine sont généralement remplies avec de l’eau de réseau plutôt équilibré (pH proche de pHe), il est OBLIGATOIRE de vérifier RÉGULIÈREMENT le pH afin de le maintenir proche de pHe. Il est donc impératif de veiller au bon équilibre de l’eau (pH, TAC et TH) afin de conserver une eau saine (non agressive et non entartrante) favorisant l’action optimale du désinfectant employé. Il est recommandé de vérifier le pH et le taux de désinfectant très régulièrement (3 fois par jour pour les collectivités). Le TAC, le TH, à la mise en route de la piscine pour modifier les paramètres si besoin et une fois par mois. On notera enfin que la température élevée de l’eau augmente les effets agressifs et entartrants, nécessitant l’emploi de produit de traitement.
XAVIER DAROK
Docteur en Chimie, Animateur du groupe de travail de normalisation Européenne: "produits chimiques utilisés dans le traitement des eaux de piscines" Expert du groupe de travail de normalisation Européenne: "produits utilisés pour la désinfection des eaux potables" Expert du groupe de travail de normalisation européenne: « Traitement de l’eau » Agent de liaison pour les comités technique de normalisation européenne "alimentation en eau" et "piscines et spas domestiques" Expert de la commission AFNOR "alimentation en eau" et "piscines et spas domestiques" Travaux au sein de la Fédération des Professionnels de la Piscine: Expert de la commission HSE.


Bonsoir,
J'aurais une question.
Les remous provoquent la montée du pH, mais également la baisse du TAC. Pourtant le pH est le TAC sont liés,. Lorsque le pH monte, le TAC monte et inversement. N'y a-t-il pas là une contradiction ?
Merci pour votre réponse.
Cordialement
Bonjour Emmanuel,
On augmente le TAC dans une piscine, en ajoutant du bicarbonate de soude. Le pH plus (carbonate de soude) contribue à augmenter légèrement l’Alcalinité (TAC).
Le TAC mesure la teneur en minéraux – bicarbonate & carbonate – présents naturellement dans l’eau. Ils sont à la fois acide & basique, ils neutralisent les variations du pH avec un effet tampon.
Les remous créent une Oxydation et libèrent le gaz carbonique, ce qui vient dissoudre le bicarbonate de soude et faire descendre naturellement le TAC. Mais ces remous n’augmente pas naturellement le pH.
Avez-vous déjà observé cette situation ?
Bonjour,
J’ai un pH a 7,3
Un tac a 12,5
Un th a 25
12,5 x 25 = 312,5 proche des 300 dc a priori mon eau est équilibrée.
Mais je lis par ailleurs que le th dois etre inferieur a 25, et plutot vers 20.
Mais si j’ai bien coumpris, un th a 20 est impossible si je veux a ph 3 garder un tac a 12 ?
Merci de votre reponse
Après traitement par ph + la piscine devint brusquement marron ce qui fût corrigé aussi brusquement par un clarifiant. Je constatai alors une piscine laiteuse et un dépôt blanc bleu gluant sur le filtre chaussette Desjoyau. Le pisciniste ne comprendpas et suppose que cela vient d'une surstabilisation . Cette coloration blanche semble donc venir d'un précipité de caco2 ? Mais cette eau marron ? Signe: le Gargamel de la piscine.